समन्वय यौगिक
अतिरिक्त यौगिक:
वे स्टोइकोमेट्रिक अनुपात में दो या दो से अधिक स्थिर यौगिकों के संयोजन से बनते हैं। ये हैं
(1) दोहरा नमक
(2) समन्वय यौगिक
डबल साल्ट:
वे योगिक यौगिक जो विलयन में अपनी पहचान खो देते हैं उदाहरण- $K_{2}SO_{4}$, $Al_{2}(SO_{4})_{3}$
समन्वय यौगिक:
वे अतिरिक्त यौगिक जो विलयन में अपनी पहचान बनाए रखते हैं (अर्थात् अपनी पहचान नहीं खोते हैं)।
$Fe(CN)_{2}$ + 4KCN $\rightarrow$ $Fe(CN)_2.4KCN$
$k_4[Fe(CN)_6] (aq)$ $ \rightleftharpoons $ $4k^+(aq)$ + $[Fe(CN)_6]^{4-}(aq)$
सेंट्रल एटम/लोन :
एक समन्वय इकाई में-परमाणु/आयन जिसके चारों ओर एक निश्चित ज्यामितीय व्यवस्था में निश्चित संख्या में लिगेंड बंधे होते हैं।
लिगैंड्स :
तटस्थ अणु, आयन या धनायन जो सीधे समन्वय इकाई में केंद्रीय धातु परमाणु या आयन से जुड़े होते हैं, लिगैंड कहलाते हैं।
चेलेट लिगैंड:
चेलेट लिगैंड एक डि या पॉलीडेंटेट लिगैंड है जो एक रिंग बनाने वाले एकल धातु आयन को बांधने के लिए अपने दो या दो से अधिक दाता परमाणुओं का उपयोग करता है।
महत्वाकांक्षी लिगैंड:
लिगैंड्स जो इसमें मौजूद दो अलग-अलग परमाणुओं के माध्यम से बंध सकते हैं
$ एम \बायां तीर चालू=ओ $
नाइट्रिटो-ओ
$\mathrm{M} \leftarrow \mathrm{SCN}$ थियोसाइनाटो या थियोसाइनाटो-एस;
$\mathrm{M} \leftarrow \mathrm{NCS}$ आइसोथियोसायनाटो या थायोसायनाटो- $\mathrm{N}$
समन्वय संख्या :
लिगैंड दाता परमाणुओं की संख्या जिनसे धातु सीधे जुड़ी होती है।
केंद्रीय परमाणु की ऑक्सीकरण संख्या:
केंद्रीय परमाणु की ऑक्सीकरण संख्या को उस आवेश के रूप में परिभाषित किया जाता है जो केंद्रीय परमाणु के साथ साझा किए गए इलेक्ट्रॉन जोड़े के साथ सभी लिगैंड को हटा दिए जाने पर वह वहन करेगा। $\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]^{3-}$ +3 है और इसे इस प्रकार लिखा जाता है $\mathrm{Fe}(\mathrm{III})$.
डेंटिटी और केलेशन:
तालिका नंबर एक
सामान्य मोनोडेंटेट लिगैंड्स
तालिका 2
सामान्य चेलेटिंग अमीन
टेबल तीन
सामान्य मल्टीडेंटेट (चेलेटिंग) लिगेंड्स
होमोलेप्टिक और हेटेरोलेप्टिक कॉम्प्लेक्स
ऐसे कॉम्प्लेक्स जिनमें एक धातु केवल एक प्रकार के दाता समूहों से बंधी होती है, उदाहरण के लिए, $[Cr(NH_3)_6]^{3+}$ , होमोलेप्टिक के रूप में जाने जाते हैं। ऐसे कॉम्प्लेक्स जिनमें एक धातु एक से अधिक प्रकार के दाता समूहों से बंधी होती है, उदाहरण के लिए, $[Co(NH_3)_4Br_2]^+$, हेटेरोलेप्टिक के रूप में जाने जाते हैं।
समन्वय यौगिकों का नामकरण
मोनोन्यूक्लियर समन्वय संस्थाओं के सूत्र लिखना
(i) केंद्रीय परमाणु को पहले रखा गया है।
(ii) फिर लिगेंड्स को वर्णानुक्रम में रखा जाता है। सूची में लिगैंड का स्थान उसके चार्ज पर निर्भर नहीं करता है।
(iii) पॉलीडेंटेट लिगेंड को भी वर्णानुक्रम में रखा जाता है। संक्षिप्त लिगैंड के मामले में, संक्षिप्त नाम के पहले अक्षर का उपयोग वर्णमाला क्रम में लिगैंड की स्थिति निर्धारित करने के लिए किया जाता है।
(iv) संपूर्ण समन्वय इकाई का सूत्र, चाहे चार्ज किया गया हो या नहीं, वर्गाकार कोष्ठक में संलग्न है। जब लिगेंड बहुपरमाणुक होते हैं, तो उनके सूत्र कोष्ठक में संलग्न होते हैं। लिगेंड्स के संक्षिप्त रूप भी कोष्ठक में संलग्न हैं।
(v) समन्वय क्षेत्र के भीतर लिगेंड और धातु के बीच कोई स्थान नहीं होना चाहिए।
(vi) जब किसी आवेशित समन्वय इकाई का सूत्र काउंटर आयन के बिना लिखा जाना है, तो चार्ज को वर्ग कोष्ठक के बाहर एक सही सुपरस्क्रिप्ट के रूप में संकेत से पहले संख्या के साथ दर्शाया जाता है। उदाहरण के लिए, $[Co(H_2O)_6]^{3+}$ , $[Fe(CN)_6]^{3-}$ वगैरह।
(vii) धनायन का आवेश ऋणायन के आवेश से संतुलित होता है।
मोनोन्यूक्लियर समन्वय यौगिकों का नाम लिखना:
(i) साधारण लवणों की तरह धनायन का नाम धनात्मक और ऋणात्मक आवेशित दोनों समन्वय इकाइयों में पहले रखा जाता है।
(ii) केंद्रीय परमाणु/आयन के नाम से पहले लिगैंड का नाम वर्णानुक्रम में रखा जाता है (लिगैंड के नाम के अनुसार, उपसर्ग के अनुसार नहीं)।
(iii) आयनिक लिगैंड के नाम -0 में समाप्त होते हैं और तटस्थ लिगैंड के नाम एक्वा को छोड़कर समान हैं $H_2O$ , के लिए अमीन $NH_3$, CO के लिए कार्बोनिल, CS के लिए थायोकार्बोनिल और NO के लिए नाइट्रोसिल। लेकिन धनायनित लिगैंड के नाम आयम में समाप्त होते हैं।
(iv) समन्वय इकाई में एक प्रकार के लिगेंड की संख्या को इंगित करने के लिए मोनो, डी, ट्राई आदि उपसर्गों का उपयोग किया जाता है। जब लिगेंड्स के नामों में एक संख्यात्मक उपसर्ग शामिल होता है या वे जटिल होते हैं या जब भी सामान्य उपसर्गों का उपयोग कुछ भ्रम पैदा करता है, तो इसे कोष्ठक में बंद कर दिया जाता है और उपसर्गों के दूसरे सेट का उपयोग किया जाता है।
(v) धनायन, ऋणायन या तटस्थ समन्वय इकाई में धातु की ऑक्सीकरण अवस्था को धातु के नाम के बाद कोष्ठक में रोमन अंक द्वारा दर्शाया जाता है।
(vi) यदि सम्मिश्र आयन एक धनायन है, तो धातु को तत्व के समान नाम दिया जाता है। उदाहरण के लिए, $\mathrm{Co}$ एक जटिल धनायन में कोबाल्ट कहा जाता है और $\mathrm{Pt}$ प्लैटिनम कहा जाता है. यदि सम्मिश्र आयन एक ऋणायन है, तो धातु का नाम प्रत्यय - खाया के साथ समाप्त होता है। उदाहरण के लिए, एक जटिल आयन में सह, $[Co(SCN)_4]^{2-}$ कोबाल्टेट कहा जाता है. कुछ धातुओं के लिए, जटिल आयनों में लैटिन नामों का उपयोग किया जाता है।
(vii) तटस्थ जटिल अणु का नाम जटिल धनायन के समान रखा गया है।
वर्नर का सिद्धांत:
वर्नर के अनुसार अधिकांश तत्व दो प्रकार की संयोजकता प्रदर्शित करते हैं:
(ए) प्राथमिक संयोजकता
(बी) द्वितीयक वैधता।
(ए) प्राथमिक संयोजकता:
यह धातु आयन की ऑक्सीकरण अवस्था से मेल खाता है। इसे प्रमुख, आयनीकरणीय या आयनिक संयोजकता भी कहा जाता है। यह ऋणात्मक आयनों से संतुष्ट होता है और केंद्रीय धातु आयन के साथ इसका जुड़ाव बिंदीदार रेखाओं द्वारा दर्शाया जाता है।
(बी) माध्यमिक या सहायक वैधता:
इसे समन्वय संख्या (आमतौर पर संक्षिप्त रूप में) भी कहा जाता है $\mathrm{CN}$ ) केंद्रीय धातु आयन का। यह गैर-आयनिक या गैर-आयनिक है (यानी सहसंयोजक बंधन प्रकार का समन्वय)। आधुनिक शब्दावली में, ऐसी स्थानिक व्यवस्था को समन्वय बहुफलक कहा जाता है और विभिन्न संभावनाएँ होती हैं
सीएन $=2$ रेखीय
सीएन $=3$ त्रिकोणीय
सीएन $=4$ चतुष्फलकीय या वर्गाकार तलीय
सीएन $=6$ अष्टफलकीय.
सिडगविक द्वारा दिया गया प्रभावी परमाणु संख्या नियम:
प्रभावी परमाणु संख्या (ईएएन) = परमाणु संख्या। केंद्रीय धातु की - केंद्रीय धातु की ऑक्सीकरण अवस्था + लिगेंड द्वारा दान किए गए इलेक्ट्रॉनों की संख्या।
वैलेंस बॉन्ड सिद्धांत:
मॉडल संकरण का उपयोग करता है $n-1 d, n s, n p$ या $n s, n p, n d$ अष्टफलकीय, वर्ग तलीय और चतुष्फलकीय जैसी प्रेक्षित संरचनाओं और परिसरों के चुंबकीय गुणों को ध्यान में रखते हुए निश्चित ज्यामिति के समतुल्य कक्षकों का एक सेट प्राप्त करने के लिए धातु परमाणु या आयन की कक्षाएँ। यौगिकों के चुंबकीय क्षण द्वारा मापी गई अयुग्मित इलेक्ट्रॉनों की संख्या यह निर्धारित करती है कि कौन से डी-ऑर्बिटल्स का उपयोग किया जाता है।
मेज़ :
समन्वय क्रमांक छह:
प्रतिचुंबकीय अष्टफलकीय परिसर में, $[Co(NH_3)_6]^{3+}$, कोबाल्ट आयन +3 ऑक्सीकरण अवस्था में है और इसका इलेक्ट्रॉनिक विन्यास नीचे दिखाए अनुसार दर्शाया गया है।
$Co(NH_3)_6^{3+}$
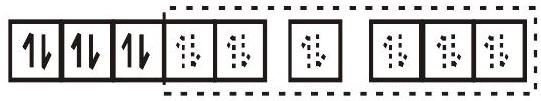
$\mathrm{d}^{2} \mathrm{sp}^{3}$ संकर कक्षीय
द कॉम्प्लेक्स $\left[\mathrm{FeF}_{6}\right]^{4-}$ अनुचुंबकीय है और संकरण में बाहरी कक्षक (4d) का उपयोग करता है $\left(\mathrm{sp}^{3} \mathrm{~d}^{2}\right)$; इस प्रकार इसे बाहरी कक्षीय या उच्च स्पिन या स्पिन मुक्त परिसर कहा जाता है। इसलिए,
$\left[\mathrm{FeF}_{6}\right]^{4-}$
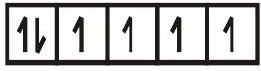
 $\mathrm{sp}^{3} \mathrm{~d}^{2}$ संकर कक्षाएँ
$\mathrm{sp}^{3} \mathrm{~d}^{2}$ संकर कक्षाएँ
समन्वय क्रमांक चार:
पैरामैग्नेटिक और टेट्राहेड्रल कॉम्प्लेक्स में $\left[\mathrm{NiCl}_{4}\right]^{2-}$, निकेल +2 ऑक्सीकरण अवस्था में है और आयन का इलेक्ट्रॉनिक विन्यास है $3 \mathrm{~d}^{8}$. संकरण योजना चित्र में दर्शाई गई है।
$\left[\mathrm{NiCl}_{4}\right]^{2-}$

$\mathrm{sp}^{3}$ संकर कक्षाएँ
वैसे ही जटिल $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$ इसमें चतुष्फलकीय ज्यामिति है और यह प्रतिचुंबकीय है क्योंकि इसमें कोई अयुग्मित इलेक्ट्रॉन नहीं है। संकरण योजना चित्र में दर्शाई गई है।
$\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$
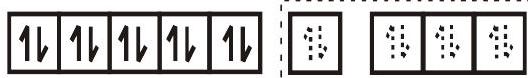
$\mathrm{sp}^{3}$ संकर कक्षाएँ
के लिए संकरण योजना $\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$ जैसा कि चित्र में दिखाया गया है।
$\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$
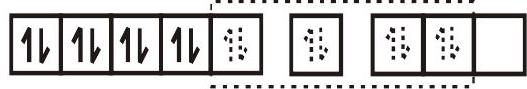
$\mathrm{dsp}^{2}$ संकर कक्षाएँ
यह निम्नलिखित कमियों से ग्रस्त है:
-
कई धारणाएँ शामिल हैं।
-
चुंबकीय डेटा की कोई मात्रात्मक व्याख्या नहीं है।
-
इसमें समन्वय यौगिकों के वर्णक्रमीय (रंग) गुणों के बारे में कुछ नहीं कहा गया है।
-
यह समन्वय यौगिकों की थर्मोडायनामिक या गतिज स्थिरता की मात्रात्मक व्याख्या नहीं देता है।
-
यह 4-समन्वय परिसरों की चतुष्फलकीय और वर्गतलीय संरचनाओं के संबंध में सटीक भविष्यवाणी नहीं करता है।
-
यह मजबूत और कमजोर लिगेंड्स के बीच अंतर नहीं करता है।
समन्वय यौगिकों के चुंबकीय गुण:
चुंबकीय पल $= \sqrt{n(n+2)}$ बोह्र मैग्नेटन;
n = अयुग्मित इलेक्ट्रॉनों की संख्या।
डी-ऑर्बिटल्स में तीन इलेक्ट्रॉनों तक वाले धातु आयनों के लिए $\mathrm{Ti}^{3+},\left(\mathrm{d}^{1}\right) ; \mathrm{V}^{3+}$ $\left(d^{2}\right) ; \mathrm{Cr}^{3+}\left(d^{3}\right)$; दो खाली $d$-अष्टफलकीय संकरण के लिए कक्षक आसानी से उपलब्ध हैं। इन मुक्त आयनों और उनकी समन्वय इकाइयों का चुंबकीय व्यवहार समान है। जब तीन से अधिक 3डी इलेक्ट्रॉन मौजूद हों, जैसे कि $\mathrm{Cr}^{2+}$ और $\mathrm{Mn}^{3+}\left(\mathrm{d}^{4}\right) ; \mathrm{Mn}^{2+}$ और $\mathrm{Fe}^{3+}\left(\mathrm{d}^{5}\right) ; \mathrm{Fe}^{2+}$ और $\mathrm{Co}^{3+}\left(\mathrm{d}^{6}\right)$; संकरण के लिए आवश्यक दो रिक्त कक्षाएँ सीधे उपलब्ध नहीं हैं (हंड के नियमों के परिणामस्वरूप)।
इस प्रकार, के लिए $d^{4}, d^{5}$ और $d^{6}$ मामले, दो खाली $d$ ऑर्बिटल्स केवल युग्मन के परिणामस्वरूप संकरण के लिए उपलब्ध हैं $3 d$ इलेक्ट्रॉन जो क्रमशः दो, एक और शून्य अयुग्मित इलेक्ट्रॉन छोड़ते हैं।
क्रिस्टल फ़ील्ड सिद्धांत:
क्रिस्टल क्षेत्र सिद्धांत (सीएफटी) एक इलेक्ट्रोस्टैटिक मॉडल है जो धातु-लिगैंड बंधन को धातु आयन और लिगैंड के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन से उत्पन्न आयनिक मानता है।
(ए) अष्टफलकीय समन्वय इकाइयों में क्रिस्टल क्षेत्र विभाजन:
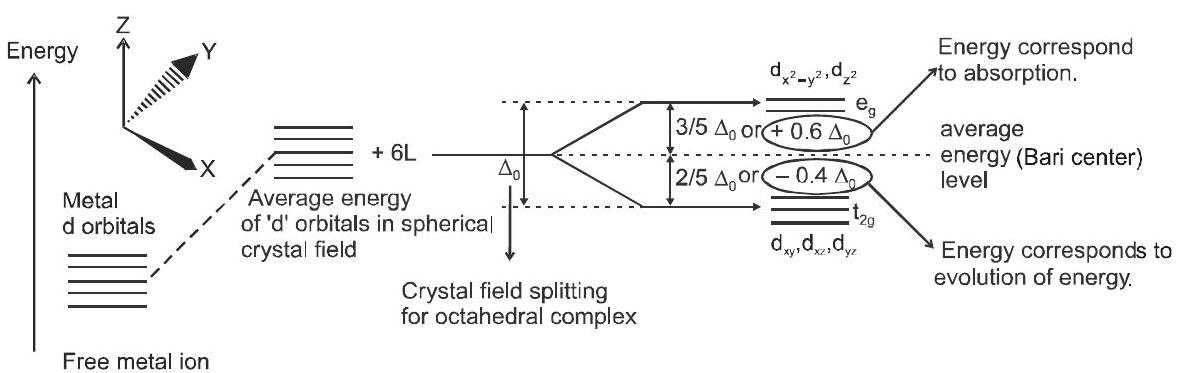
चित्र अष्टफलकीय परिसर में क्रिस्टल क्षेत्र को विभाजित करते हुए दिखा रहा है।
क्रिस्टल क्षेत्र का विभाजन, $\Delta_{0}$, लिगैंड द्वारा उत्पादित क्षेत्रों और धातु आयन पर आवेश पर निर्भर करता है। लिगेंड्स को क्षेत्र की ताकत बढ़ाने के क्रम में एक श्रृंखला में व्यवस्थित किया जा सकता है जैसा कि नीचे दिया गया है:
$I^{-}$ < $Br^{-}$ < $SCN^{-}$ < $Cl^{-}$ < $S^{2-}$ < $F^{-}$ < $OH^{-}$ < $C_{2}O_{4}^{2-}$ < $H_{2}O$ < $NCS^{-}$ < $edta^{4-}$ < $NH_{3}$ < एन $NO_{2-}$ < $CN^{-}$ <सीओ
ऐसी श्रृंखला को स्पेक्ट्रोकेमिकल श्रृंखला कहा जाता है। यह विभिन्न लिगेंड्स वाले कॉम्प्लेक्स द्वारा प्रकाश के अवशोषण पर आधारित एक प्रयोगात्मक रूप से निर्धारित श्रृंखला है।
क्रिस्टल क्षेत्र स्थिरीकरण ऊर्जा (सीएफएसई) की गणना
फॉर्मूला: सीएफएसई $=\left[-0.4(n) t_{2 g}+0.6\left(n^{\prime}\right) e_{g}\right] \Delta_{0}+{ }^{*} n P$.
जहां n और n’ इलेक्ट्रॉनों की संख्या हैं $t_{2g}$ & $e_{g}$ क्रमशः कक्षाएँ और $\Delta_{0}$ अष्टफलकीय परिसर के लिए क्रिस्टल क्षेत्र विभाजन ऊर्जा। *n सामान्य पतित विन्यास की तुलना में लिगेंड के कारण बनने वाले अतिरिक्त इलेक्ट्रॉन युग्मों की संख्या को दर्शाता है।
(बी) टेट्राहेड्रल समन्वय इकाइयों में क्रिस्टल क्षेत्र विभाजन:
टेट्राहेड्रल समन्वय इकाई गठन में, डी कक्षीय विभाजन उल्टा होता है और अष्टफलकीय क्षेत्र विभाजन की तुलना में छोटा होता है। समान धातु के लिए, समान लिगैंड और धातु-लिगैंड दूरी, यह दिखाया जा सकता है $\Delta_{\mathrm{t}}=(4 / 9) \Delta_{0}$.
चतुष्फलकीय परिसर में क्रिस्टल क्षेत्र के विभाजन को दर्शाने वाला चित्र।
समन्वय यौगिकों में रंग:
क्रिस्टल क्षेत्र सिद्धांत के अनुसार रंग लिगेंड के प्रभाव में इलेक्ट्रॉन के dd संक्रमण के कारण होता है। हम जानते हैं कि किसी पदार्थ का रंग विद्युत चुम्बकीय स्पेक्ट्रम (400 से 400) के दृश्य भाग में एक विशिष्ट तरंग दैर्ध्य पर प्रकाश के अवशोषण के कारण होता है। $700 \mathrm{~nm}$ ) और बाकी तरंग दैर्ध्य का संचरण या प्रतिबिंब।
क्रिस्टल क्षेत्र सिद्धांत की सीमाएँ
(1) यह केवल धातु आयन डी-ऑर्बिटल्स पर विचार करता है और अन्य धातु ऑर्बिटल्स (जैसे) पर कोई विचार नहीं करता है $s, p_{x}, p_{y}$ और $p_{z}$ ऑर्बिटल्स)।
(2) यह लिगेंड्स की सापेक्ष शक्तियों का संतोषजनक हिसाब लगाने में असमर्थ है। उदाहरण के लिए, यह इसका कोई स्पष्टीकरण नहीं देता कि ऐसा क्यों है $\mathrm{H}_{2} \mathrm{O}$ से अधिक मजबूत लिगैंड है $\mathrm{OH}^{-}$स्पेक्ट्रोकेमिकल श्रृंखला में.
(3) इस सिद्धांत के अनुसार, धातु और लिगेंड के बीच का बंधन विशुद्ध रूप से आयनिक होता है। यह धातु लिगैंड बांड की आंशिक रूप से सहसंयोजक प्रकृति पर कोई हिसाब नहीं देता है।
(4) सीएफटी इसका हिसाब नहीं दे सकता $\pi$-संकुलों में बंधन।
समन्वय यौगिकों की स्थिरता:
एक समन्वय यौगिक की स्थिरता $\left[\mathrm{ML}_{\mathrm{n}}\right]$ अभिव्यक्ति द्वारा दिए गए स्थिरता स्थिरांक (संतुलन स्थिरांक) के संदर्भ में मापा जाता है,
$\beta_n = [ML_n]/[M(H_2O)_n[L]^n]$
समग्र प्रतिक्रिया के लिए: $M\left(H_2 O\right)_n+n L \rightleftharpoons ML_n+nH_2 O$
परंपरा के अनुसार, विस्थापित पानी को नजरअंदाज कर दिया जाता है, क्योंकि इसकी सांद्रता अनिवार्य रूप से स्थिर रहती है। उपरोक्त समग्र प्रतिक्रिया स्थिरता (गठन) स्थिरांक के साथ चरणों में होती है, $K_1, K_2, K_3, \ldots . . K_n$ प्रत्येक चरण के लिए जैसा कि नीचे दर्शाया गया है:
$\beta_{\mathrm{n}}$स्थिरता स्थिरांक, थर्मोडायनामिक स्थिरता से संबंधित होता है जब सिस्टम संतुलन पर पहुंच जाता है।
आइसोमेरिज्म:
(1) संरचनात्मक समरूपता:
(ए) आयनीकरण समावयवता:
इस प्रकार की समावयवता तब होती है जब एक समन्वय यौगिक में काउंटर आयन स्वयं एक संभावित लिगैंड होता है और एक लिगैंड को विस्थापित कर सकता है जो फिर काउंटर आयन बन सकता है।
$[CO(NH_3)SO_4]NO_3$ और $[CO(NH_3)_5NO_3]SO_4$
(बी) सॉल्वेट/हाइड्रेट आइसोमेरिज्म:
यह तब होता है जब पानी समन्वय इकाई का हिस्सा बनता है या उसके बाहर होता है।
(सी) लिंकेज आइसोमेरिज्म:
कुछ लिगेंडों में, जैसे उभयलिंगी लिगैंड्स में, दो संभावित समन्वय स्थल होते हैं। ऐसे मामलों में, लिंकेज
समरूपता विद्यमान है। उदाहरणार्थ,
उदाहरण के लिए : $[Co(ONO)(NH_3)_5]Cl_2$ & $[Co(NO_2)(NH_3)_5]Cl_2$
(डी) समन्वय समरूपता:
धनायनिक और ऋणायन समन्वय इकाइयों से बने समन्वय यौगिक धनायन और ऋणायन इकाइयों के बीच लिगेंड के आदान-प्रदान के कारण इस प्रकार की समावयवता दिखाते हैं। कुछ उदाहरण हैं:
$[Co(NH_3)_6][Cr(CN)_6]$ & $[Cr(NH_3)_6][Co(CN)_6]$
(ई) लिगैंड समावयवता:
चूँकि कई लिगेंड कार्बनिक यौगिक होते हैं जिनमें समावयवता की संभावना होती है, परिणामी परिसर इस स्रोत से समावयवता दिखा सकते हैं।
(एफ) पॉलिमराइजेशन आइसोमेरिज्म:
समन्वय समावयवता का एक विशेष मामला माना जाता है, इसमें विभिन्न समावयवी एक दूसरे से सूत्र भार में भिन्न होते हैं, इसलिए वास्तविक अर्थों में सच्चे समावयवी नहीं होते हैं।
(2). स्टीरियोइसोमेरिज्म
ज्यामितीय समावयवता
समन्वय संख्या 4 और 6 वाले समन्वय यौगिकों में ज्यामितीय समावयवता आम है।
समन्वय क्रमांक चार :
टेट्राहेड्रल कॉम्प्लेक्स:
चतुष्फलकीय यौगिक ज्यामितीय समावयवता नहीं दिखा सकते क्योंकि हम सभी जानते हैं कि चतुष्फलकीय ज्यामिति में सभी चार स्थितियाँ समतुल्य हैं।
स्क्वायर प्लेनर कॉम्प्लेक्स:
वर्गाकार तलीय प्रकार का संकुल $\mathrm{Ma}_{2} \mathrm{bc}$ (कहाँ $\mathrm{a}, \mathrm{b}, \mathrm{c}$ अज्ञात हैं) दो ज्यामितीय आइसोमर्स दिखाता है।

Mabcd प्रकार का वर्गाकार तलीय परिसर (जहाँ a,b,c,d एकदिष्ट हैं) तीन ज्यामितीय आइसोमर्स दिखाता है।
समन्वय संख्या छह:
अष्टफलकीय संकुलों में ज्यामितीय समावयवता भी संभव है।
ज्यामितीय आइसोमर्स (सीआईएस और ट्रांस)। $[Co(NH_3)_4Cl_2]^+$
विशिष्ट परिसरों के लिए केंद्रीय धातु आयन के आसपास संभावित आइसोमर्स की संख्या और लिगेंड की स्थानिक व्यवस्था नीचे दी गई है।
(I) ऐसे कॉम्प्लेक्स जिनमें केवल एकदन्तहीन लिगेंड होते हैं
1- $Ma_2b_4$ - 2
2- $Ma_4bc$ - 2
3- $Ma_3b_3$
(II) बाइडेंटेट लिगैंड और अनआइडेंटेट लिगैंड युक्त यौगिक
(मैं) $\quad M(A A) a_{3} b-$ दो ज्यामितीय आइसोमर्स संभव हैं।
(ii) $M(AA)a_2b_2$ - तीन ज्यामितीय आइसोमर्स संभव हैं।
नोट: साथ में $\left[M(A A) b_{4}\right]$, केवल एक ही फॉर्म संभव है. $M(A A)$ एबीसीडी में छह ज्यामितीय आइसोमर्स हैं।
(iii)साथ $M(AA)_2O_2$ - दो ज्यामितीय आइसोमर्स संभव हैं।
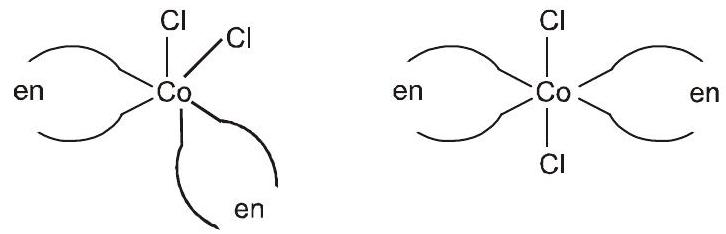
ज्यामितीय आइसोमर्स (सीआईएस और ट्रांस)। $[CoCl_2(en)_2]$
ऑप्टिकल आइसोमेरिज्म:
एक समन्वय यौगिक जो ध्रुवीकृत प्रकाश के तल को घुमा सकता है उसे ऑप्टिकली सक्रिय कहा जाता है।
अष्टफलकीय परिसर:
डिडेंटेट लिगेंड से जुड़े अष्टफलकीय परिसरों में ऑप्टिकल आइसोमेरिज्म आम है। उदाहरण के लिए, $\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$ है $\mathrm{d}$ और $\ell$ नीचे दिए गए अनुसार फॉर्म।
वर्गाकार समतलीय परिसर:
ऑप्टिकल आइसोमेरिज्म दिखाने के लिए स्क्वायर प्लेनर कॉम्प्लेक्स शायद ही कभी पाए जाते हैं। चार लिगेटिंग परमाणुओं और धातु आयन द्वारा निर्मित विमान को एक दर्पण विमान माना जाता है और इस प्रकार चिरलिटी की संभावना को रोकता है।
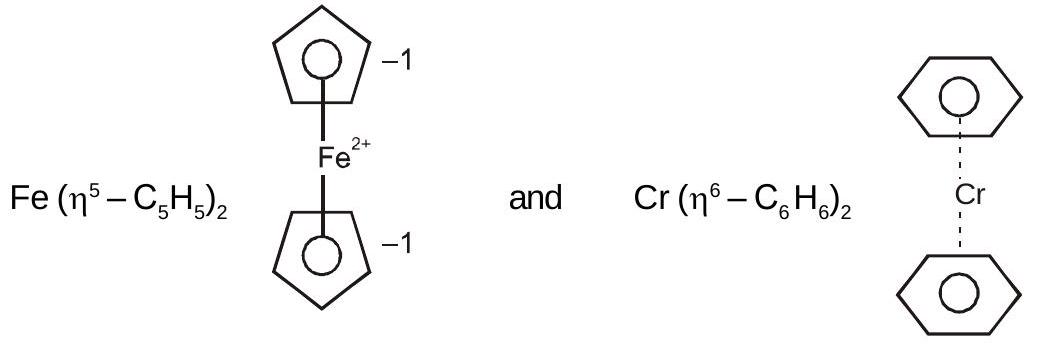
ऑर्गनोमेटेलिक यौगिक
धातु कार्बोनिल्स:
धातुओं के यौगिक $\mathrm{CO}$ लिगैंड के रूप में धातु कार्बोनिल्स कहलाते हैं।
ये दो प्रकार के होते हैं.
(ए) मोनोमेरिक: वे धातु कार्बोनिल जिनमें प्रति अणु केवल एक धातु परमाणु होता है, मोनोमेरिक कार्बोनिल कहलाते हैं। उदाहरण के लिए : $[Ni(CO)_4]$ $(sp^3,tetrahedral)$ ; $[Fe(CO)_5]$ $(dsp^3, \text{trigonal bipyramidal})$.
(बी) पॉलिमरिक: वे धातु कार्बोनिल जिनमें प्रति अणु दो या दो से अधिक धातु परमाणु होते हैं और उनमें धातु-धातु बंधन होते हैं, पॉलिमरिक कार्बोनिल कहलाते हैं। उदाहरण के लिए : $Mn_2(CO)_{10}$, $Co_2(CO)_9$, वगैरह।
$\mathrm{M}-\mathrm{C} \pi$ बांड का निर्माण भरे हुए इलेक्ट्रॉनों की एक जोड़ी के दान से होता है $d$ रिक्त प्रतिरक्षी में धातु की कक्षा $\pi^{\star}$ कार्बन मोनोऑक्साइड की कक्षा. इस प्रकार कार्बन मोनोऑक्साइड कार्य करता है $\sigma$ दाता $(\mathrm{OC} \rightarrow \mathrm{M})$ और ए $\pi$ हुंडी सकारनेवाला $(O C \leftarrow M)$, दो अंतःक्रियाओं के साथ एक सहक्रियात्मक प्रभाव पैदा होता है जो बीच के बंधन को मजबूत करता है $\mathrm{CO}$ और धातु जैसा कि चित्र में दिखाया गया है।
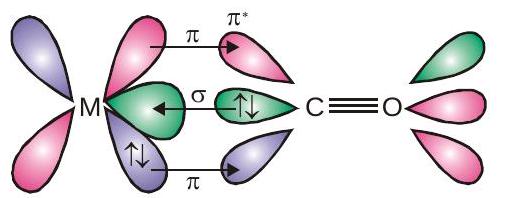
सहक्रियात्मक बंधन
सिग्मा $(\sigma)$ बंधित ऑर्गेनोमेटेलिक यौगिक :
(ए) ग्रिग्नार्ड अभिकर्मक $\mathrm{R}-\mathrm{Mg}-\mathrm{X}$ कहाँ $\mathrm{R}$ एक एल्काइल या एरिल समूह है और $\mathrm{X}$ हैलोजन है.
(बी) $(CH_3)_4Sn$, $(C_2H_5)_4Pb$, $Al_2(CH_3)_6$, $Al_2(C_2H_5)_6$ वगैरह।
पाई-बंधित ऑर्गेनोमेटेलिक यौगिक:
ये एल्कीन, एल्काइन, बेंजीन और अन्य रिंग यौगिकों के साथ धातु के यौगिक हैं।
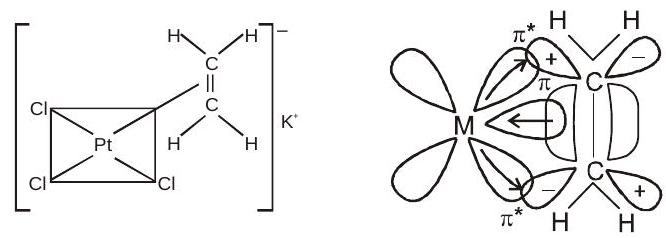
ज़ीज़ का नमक:
$K[PtCl_{3}(\eta^{2}-C_2 H_4)]$
फेरोसीन और बीआईएस (बेंजीन) क्रोमियम: